Ordtaket om at alt ligger i genene, er en sannhet med bokstavelig talt store modifikasjoner. Alle levende organismer er produkter av arv og miljø, og ved nettopp å modifisere genene, påvirker miljøet i stor grad hvor mye et gen bestemmer en organismes egenskaper. I de senere årene har det blitt klart at disse miljøeffektene ikke bare kan overføres fra celle til celle gjennom celledelingen, men også til neste generasjon gjennom kjønnscellene. Dette kalles epigenetisk arv. Mye av kunnskapen om disse epigenetiske fenomenene kan vi takke planteforskning for.
Av Tage Thorstensen i GENialt 2/2010
Da den amerikanske forskeren Barbara McClintock tidlig på 1950-tallet publiserte banebrytende arbeid fra studier i mais, hvor hun beskrev fenomenet «hoppende gener», eller bevegelige DNA-elementer (transposoner), var det få av samtidens forskere som trodde på henne. McClintock forsket på hvordan transposoner kunne flytte seg fra én posisjon på kromosomet til en annen og på den måten forårsake forandringer i gener som regulerte fargen på maisfrø. Hennes resultater var forut for sin tid, noe som illustreres ved at hun først fikk nobelprisen for dette arbeidet i 1983, mer enn 30 år etter at hun gjorde oppdagelsen. Siden har transposoner vist seg å utgjøre en oppsiktsvekkende stor andel av arvestoffet til de fleste planter og dyr, inkludert 50 prosent av det humane genomet og 90 prosent av maisgenomet. Transposoner har dermed stor betydning for organiseringen og utviklingen av genomene.
Like gener, men likevel ulike – hvordan er det mulig?
At et DNA-element som settes inn i et gen kan forandre dets funksjon eller føre til kromosomforandringer, er lett å forestille seg. Men McClintock var også den første som kom med teorier om hvordan gener skrus av eller på (uttrykkes) og at også denne genreguleringen er arvelig. Dette er senere blitt referert til som epigenetikk. Alle cellene i en flercellet organisme inneholder det samme arvestoffet eller genmaterialet, likevel er det store forskjeller i hvordan de ulike cellene ser ut og hva slags funksjon de har. En hudcelle inneholder akkurat den samme geninformasjonen som en muskelcelle – likevel er de totalt forskjellige og har helt ulike funksjoner. Eneggede tvillinger har identisk arvestoff, men selv om de er veldig like, er de ikke helt identiske. Dette fenomenet så også McClintock i sine studier av frøfarge i mais. Hun viste hvordan genetisk identiske celler kunne ha varierende genuttrykk, og dermed ulikt utseende, som ble overført fra cellegenerasjon til cellegenerasjon gjennom celledelingen. Hun foreslo at disse forskjellene skyldtes variasjoner i hvordan de ulike cellene kunne lese informasjonen i genene, og at inaktive gener skyldtes at de var «dekket av ikke-genetisk kromatinmateriale». Nå, mer enn 50 år etter, er det lett å la seg imponere over hvor treffende denne hypotesen var, til tross for at den ble fremsatt før strukturen på DNA-heliksen var publisert. At to celletyper i et individ ser forskjellig ut (ulik fenotype), skyldes at ulike gener er av eller på i de to celletypene, eller at det er varierende mengdeforhold mellom det som lages fra genene, slik som proteiner. Disse forskjellene skyldes i stor grad at det er forskjeller i kromatinstruktur, det vil si hvor tett DNA-et er sammenpakket med proteiner. Kromatinstrukturen styres av ulike epigenetiske modifikasjoner (se figur), som gjør at genene blir mer eller mindre lesbare for cellen. Dette kan sammenlignes med en avis: Er den åpen, er det mulig å lese innholdet, men hvis vi krøller den sammen, er det ikke lenger mulig å lese informasjonen. Når disse forandringene i genuttrykk og kromatinstruktur arves fra celle til celle gjennom cellesyklusen, eller fra individ til avkom gjennom kjønnscellene, uten at selve gensekvensen forandrer seg, snakker vi om epigenetisk arv. Denne typen arv er forskjellig fra klassisk, mendelsk arv, hvor gener arves som relativt uforanderlige enheter og fordeles tilfeldig i kjønnscellene.
Ved å kombinere ny DNA-sekvenseringsteknologi med detaljert analyse av de ulike epigenetiske modifikasjonene, har det blitt mulig å lage epigenetiske kart som sier noe om hvilke gener som er skrudd på og hvilke som er skrudd av i forskjellige celletyper. Det viser seg at måten de epigenetiske modifikasjonene fordeler seg langs genomet på, det såkalte epigenomet, varierer fra celletype til celletype og fra cellestadium til cellestadium. Selv om vi bare har ett genom som er relativt likt i alle cellene våre, har vi hundrevis av forskjellige epigenomer. Disse epigenomene forandrer seg gjennom utviklingen fra embryo til voksent menneske, ved miljøpåvirkning og fra celletype til celletype.
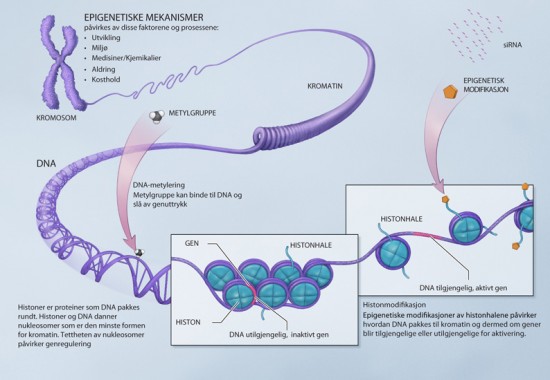
FAKTA – Epigenetiske modifikasjoner
På samme måte som at DNA-et vårt består av en genetisk kode som sier noe om hva slags proteiner som skal lages, er det i løpet av det siste tiåret blitt allment akseptert at også epigenetikken styres av en kode, nemlig «histonkoden». Det er en stor utfordring å få plass til et langt DNA-molekyl i en veldig liten cellekjerne samtidig som det foregår en streng kontroll av hvilke gener som skal være av eller på til enhver tid. For eksempel er lengden av menneskets genom ca. 2 meter langt, mens kjernen det skal få plass i, bare er 10 μm i diameter. For å organisere DNA-et slik at det får plass i kjernen samtidig som de riktige genene kan leses, pakkes det rundt proteiner som kalles histoner. DNA og histoner danner til sammen nukleosomer, som er den minste enheten av kromatin (se figur). Histonene har proteinhaler som kan modifiseres ved at spesielle enzymer legger på forskjellige kjemiske grupper. Dette påvirker hvor tett kromatinstrukturen skal være og dermed også om et gen kan slås av eller på. Grovt sagt vil gener som er i tettpakkede DNA-områder være av, mens gener i løsere pakkede DNA-områder vil være på. Kombinasjonen av disse modifikasjonene og deres effekt på kromatinstrukturen og genuttrykket kalles histonkoden. Bestemte kombinasjoner gir en løsere kromatinstruktur, mens andre gir en tettere struktur. Kombinasjonene som fører til en tettere kromatinstruktur har vist seg å være tett knyttet til to andre epigenetiske mekanismer for å skru av gener: små RNA-molekyler, som er enkelttrådete kopier av DNA-tråden, og metylering av DNA (se figur). Metylering vil si at en kjemisk gruppe – en metylgruppe (CH3) – blir koblet på DNA-et. Forskning på både planter og pattedyr viser at små RNA-molekyler er involvert i å styre DNA-metylering og histonmodifisering til deler av genomet som inneholder transposoner, og at dette kan slå av nabogener. Et gen (agouti-genet) i mus styres av mengden DNA-metylering av et transposon som er satt inn i et område (promotoren) som styrer genuttrykket. Lite DNA-metylering av transposonet gir avkom med gul pelsfarge, fedme og større risiko for kreft, mens mye DNA-metylering skrur av transposonet og gir normale avkom med mørk pelsfarge. All DNA-metylering foregår imidlertid ikke på transposoner, og hva som styrer DNA-metylering til riktig sted på DNAtråden, forskes det mye på. Forskning på ugressplanten Arabidopsis thaliana (vårskrinneblom) og humane stamceller tyder på at noe av forklaringen ligger i hvordan nukleosomene (DNA og histoner) er posisjonert langs genomet. I denne studien, som er publisert i tidsskriftet Nature i slutten av mai 2010, viser forskerne at DNA som er bundet til nukleosomer metyleres i mye større grad enn DNA som ikke er bundet til nukleosomer.
Miljøet påvirker egenskapene
Hvilke faktorer er det som påvirker epigenomet? I løpet av de siste årene har det kommet mange publikasjoner som viser at miljøpåvirkning tidlig i livet regulerer kromatinorganiseringen og dermed genuttrykket som overføres fra celle til celle gjennom celledelingen, og til neste generasjon gjennom kjønnscellene. På denne måten kan en organisme «huske» miljøet tidlig i utviklingen, noe som blant annet regulering av blomstringstid i planter er et eksempel på. Mange planter er avhengige av å blomstre på bestemte tider av året for at blomstene skal rekke å utvikle seg, etterfulgt av forhold som gjør at frøene får modnet tilstrekkelig etter befruktning. For å klare dette har de gjennom evolusjonen utviklet systemer for å føle miljøet og endre veksten og utviklingen sin deretter. I tempererte strøk må for eksempel mange planter gjennomgå en kuldeperiode før de kan blomstre til riktig tid om våren. Plantene har evne til å huske denne kuldeperioden over lang tid og gjennom mange celledelinger fordi de først mange måneder etter kuldeperioden faktisk begynner å blomstre. Selv planter som er avhengige av en kuldeperiode på frøstadiet, husker denne gjennom utviklingen, til de til slutt blomstrer på det voksne stadiet. Forskning på modellplanten Arabidopsis thaliana viser at denne evnen til å huske skyldes epigenetiske mekanismer, hovedsakelig metylering av histoner (se tekstboks), som slår av genet som hindrer blomstring.
På samme måte er kosthold en miljøfaktor som kan påvirke de epigenetiske modifikasjonene av bestemte gener. Nylig ble det publisert en artikkel som viser at mus som fødes av mødre med et høyt alkoholkonsum under graviditeten, har høyere risiko for å få avkom med føtalt alkoholsyndrom (FAS). Studien tyder på at de mentale og fysiske defektene som disse individene kjennetegnes ved, delvis kan skyldes epigenetiske mekanismer. For noen år siden viste en studie fra Sverige at det var en sammenheng mellom frekvensen av diabetes hos barn og hvordan deres bestefedre og bestemødre sultet da de var i henholdsvis puberteten og i mors liv på 1930-tallet. Hvordan kan miljøbetingelser på tidspunktet for dannelse av kjønnsceller overføres fra generasjon til generasjon for så å påvirke barnebarna? Dette eksempelet har senere blitt bekreftet av en mengde studier som viser at miljøpåvirkning som for eksempel stress, kosthold og temperatur, kan påvirke fremtidige generasjoner. Det interessante er at disse arvbare forandringene i fenotypen ikke gjenspeiler seg i forandringer eller mutasjoner i selve DNA-sekvensen til genene.
I 2005 ble det publisert en studie i Science som viste at hannrotter som ble utsatt for en soppgift på fosterstadiet, hadde økt risiko for å utvikle kreft og nyresvikt. Disse effektene ble overført i tre påfølgende generasjoner, og det viste seg at dette kunne skyldes forandret metylering av DNA-et i sædcellene. Dette viser at epigenetiske mekanismer ikke bare overføres fra celle til celle gjennom vanlig celledeling (mitose), men også ved den typen celledeling som gir kjønnsceller (meiose). Dermed kan epigenetiske modifikasjoner, med de effekter det har på genuttrykk, overføres til senere generasjoner.
Vil helgenomsekvensering gi svaret på alt?
Med de nye DNA-sekvenseringsteknikkene vil det være mulig å sekvensere personlige genomer som kan gi oss muligheten til å få informasjon om alle sykdommer vi er disponert for gjennom genene (se GENialt 1/2010). Det er imidlertid ikke gitt at man utvikler en sykdom selv om man har en genmutasjon som skulle tilsi det, fordi miljømessige eller epigenetiske faktorer påvirker hvordan dette genet uttrykkes. Vi arver to kopier av hvert gen; én kopi fra far og én kopi fra mor. Preging av gener (parental imprinting) er en prosess hvor metylering av DNA-et fører til inaktivering, slik at den ene av kopiene ikke kan leses i avkommet. Det kan gjelde uttrykket av ett gen eller hele genområder og kromosomer. For eksempel vil en jente som har arvet en spesiell genfeil, få Angelmans syndrom hvis hun har fått den fra sin mor, men ikke hvis hun har fått den fra sin far, fordi kopien fra far er inaktiv. Det er heller ikke gitt at to genetisk identiske individer, som eneggede tvillinger (les mer om dette i GENialt 3/2006), blir identiske fordi de utsettes for forskjellig miljø gjennom oppveksten. Dermed vil de også kunne ha forskjellige epigenom. Dette viser at sammenhengen mellom genmutasjoner og sykdom, og hva som er arv og hva som er miljø, er svært kompleks. Mye av denne kompleksiteten skyldes den epigenetiske informasjonen som ligger oppå genene.
Kilder:
- Slotkin R., and Martienssen R. (2007) Transposable elements and the epigenetic regulation of the genome, Nature Reviews Genetics 8, 272– 285.
- Lisch P. (2009) Epigenetic regulation of transposable elements in plants, Annual Review of Plant Biology, 60, 43–66. – Scitable by Nature education, www.nature. com/scitable.
 Last ned pdf av denne artikkelen slik den stod på trykk i GENialt 2/2010.
Last ned pdf av denne artikkelen slik den stod på trykk i GENialt 2/2010.



