Genteknologi som genspleising, genmodifisering og genredigering er en gruppe teknologier som endrer den genetiske sammensetningen av en organisme, enten det er menneskers gener eller genene til det som lever rundt oss. Genteknologi brukes i dag innen både medisin, forskning, plante- og dyreforedeling, i legemiddelproduksjon og bioteknologisk industri. Metodene er stadig under utvikling, og genredigeringsverktøyet Crispr er det siste tillegget.
Oppskriften på egenskapene til hvert eneste menneske, dyr, plante, sopp eller mikroorganisme ligger lagret som en kjemisk kode i arvematerialet, DNA (les mer om hvordan DNA bestemmer egenskaper på temaside om arv og genetikk). Men selv uten å kjenne til DNA-molekylet har mennesker gjennom tusenvis av år formet mange arters genetikk ved å velge ut og krysse individer med gunstige egenskaper. Slik har vi fått frem både nyttige matplanter, produksjonsdyr og kjæledyr. Da James Watson og Francis Crick i 1953 beskrev strukturen til DNA-molekylet, og den genetiske kode senere ble oppdaget og mulig å lese av, la det grunnlaget for genteknologi: en rekke ulike teknikker for å undersøke, isolere, kopiere og endre DNA. Men genteknologi gjør det også for første gang mulig for mennesker å endre levende organismers egenskaper ved å gjøre endringer direkte i DNA-sekvensen. De første genteknologiske metodene for å endre organismers DNA baserte seg på å sette inn nye gener i arvematerialet – ofte på tvers av artsgrensene. Det er dette som blir omtalt som genspleising eller rekombinant DNA-teknikk. Organismene som fikk ekstra genetisk materiale «limt inn» blir kalt genmodifiserte organismer (GMO). De siste årene er det utviklet metoder for å gjøre mer målrettede endringer i gener, ofte uten at man må «lime inn» ekstra DNA. Dette kalles genredigering.
På denne temasiden om hvordan genteknologi brukes for å endre i gener skal vi forklare noen av de viktigste genteknologiske metodene. Du kan lese mer om hva genteknologi blir brukt til på følgende temasider: genmodifiserte dyr, genmodifiserte mikroorganismer, genmodifiserte planter og genterapi.
De vitenskapelige fremskrittene
Det var flere viktig vitenskapelig fremskritt på 1970-tallet som for første gang gjorde det mulig å endre på gener med genteknologi. I 1971 viste Paul Berg og hans kolleger som jobbet med isolert DNA fra ulike virus, at det var mulig å klippe DNA-et i biter og lime DNA-et sammen igjen. Dette fikk de til ved å bruke ulike enzymer, kalt restriksjonsenzymer, som kjenner igjen og klipper i en DNA-sekvens.
På omtrent samme tid var det andre forskere som studerte hvordan skadet DNA blir reparert. De fant ut at andre enzymer, kalt DNA-ligaser, kan lime sammen DNA som har blitt brutt. Ved å bruke restriksjonsenzymer til å klippe ut enkeltgener, for så å lime sammen ulike gener med DNA-ligaser, klarte Berg i 1972 å lage det første genspleisede DNA-et, såkalt rekombinert DNA.
Men for at genspleiset DNA skal bety noe for liv, så må det inn i en celle. Allerede i 1944 ble det vist at noen bakterier tar opp DNA fra omgivelsene sine. Senere fant en frem til metoder for å få bakterier til å ta opp DNA i laboratoriet, som ved å gi cellene et lite elektrisk støt eller bruke varmebehandling. I 1973 ble dette brukt for første gang til å sette inn et genspleiset DNA i tarmbakterien E. coli. Forskerne genspleiset DNA ved å klippe ut et antibiotikaresistensgen fra én stamme E. coli, for så å lime det inn i et plasmid, et slags ekstra bakterie-kromosom, som deretter ble satt inn i andre E. coli-bakterier. De bakteriene som hadde tatt opp plasmidet med antibiotikaresistensgen vokste godt selv med antibiotika til stede. Men bakteriene uten det genspleisede DNA-et døde. Slik kunne forskerne forsikre seg om at det var kun genmodifiserte bakterier som formerte seg. Disse bakteriene var de aller første genmodifiserte organismene. Senere ble det utviklet metoder for å levere genspleiset DNA til planter, dyr og mennesker. Les mer om bruken på temasidene om genteknologi i planter, dyr, mikroorganismer og genterapi.
En ulempe med å bruke restriksjonsenzymer til å klippe i større genom, er at det er vanskelig å klippe på nøyaktig ønsket sted uten også å klippe andre steder i genomet. Mer spesifikke kutteenzymer har blitt utviklet, med varierende effektivitet, og med mulighet for å tilpasse enzymene til å klippe akkurat der de skal i genomet. Ved genspleising endrer man dessuten genomet ved å tilføre mer DNA, ikke ved å endre på et gen der det er. Særlig i organismer med stort arvemateriale (som planter) er dette tidkrevende og det er vanskelig å styre hvor i organismens arvemateriale det nye ekstra DNA-et limes inn.
Fra genspleising til genredigering
På 1990-tallet fikk man de første enzymene som kunne skreddersys til å kutte i en spesifikk gensekvens i en levende celle, Zinc Finger Nucleaser (ZFN). Ulempen var at det var både komplisert og tidkrevende å designe effektive «gensakser» på denne måten. Slike tidlige «gensakser» ble mest brukt i grunnforsking for å for eksempel studere effekten av å introdusere en endring (mutasjon) i en kjent genkode. Det er slike metoder for å gjøre presise endringer i en DNA-sekvens som i dag ofte omtales som genredigering (les mer på temaside om genredigering og Crispr).
Rundt 2010 kom en ny og forbedret metode; Transcription activator-like effector nucleases (TALEN). TALEN-gensakser er både lettere å designe, og mer effektive og presise enn ZFN, men er større og vanskeligere å levere inn i celler. Men i 2012 presenterte to forskere, Jennifer Doudna og Emmanuelle Charpentier CRISPR-Cas9, et nytt genredigeringsverktøy som løste flere av utfordringene ved både ZFN- og TALEN-metodene. Crispr og TALEN ble utviklet omtrent samtidig, men det er CRISPR som brukes mest og som i dag er den viktigste genredigeringsteknologien. Crispr-verktøyet er enklere og rimeligere å skreddersy til å klippe i en ønsket DNA-sekvens enn andre genredigeringsverktøy og kan brukes i alle celler og organismer. I tiåret som er gått siden Crispr-metoden ble utviklet har forskere verden over tatt Crispr i bruk som et viktig verktøy innen både forskning og utvikling av genredigerte organismer til for eksempel matproduksjon og medisin.
Doudna og Charpentier fikk Nobelsprisen i kjemi i 2020 for sitt arbeid med Crispr.
Klassisk genmodifisering
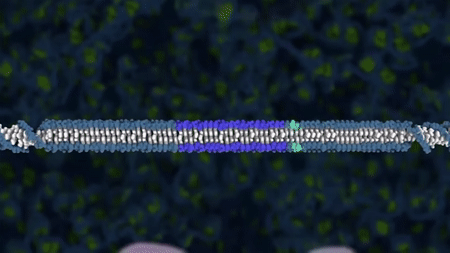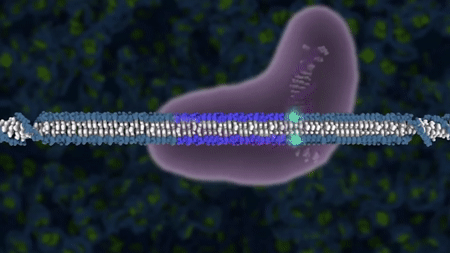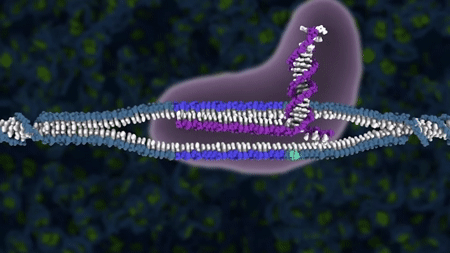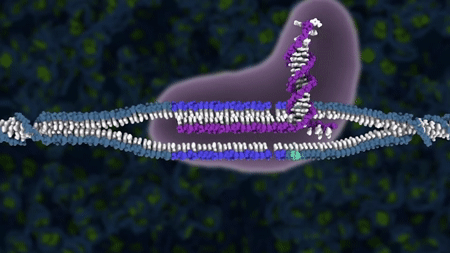
Klassisk genmodifisering er en type genteknologi som gjør det mulig å sette inn (genspleise) ekstra DNA i en organisme. Det var dette forskerne gjorde i 1973 da de satt inn et stykke DNA som kodet for antibiotikaresistens, inn i E. coli-bakterier. Antibiotikarestistensgenet ble flyttet mellom ulike stammer av samme bakterieart, og når man flytter gener innen samme art kaller man den nye organismen cisgen. Dersom det innspleisede genet hadde blitt flyttet mellom ulike arter, hadde organismen blitt kalt for transgen. Det er slike organismer med genspleiset DNA som var utgangspunktet for begrepet genmodifisert organisme (GMO).
En av de første gangene klassisk genmodifisering fikk praktisk anvendelse utenfor laboratoriet, var da forskere på 1980-tallet genmodifiserte E. coli-bakterier slik at bakteriene produserte humant insulin. Pasienter med diabetes type 1 klarer ikke selv å lage insulin, og må få insulin tilført. Tidligere brukte man insulin fra bukspyttkjertelen til gris. Dette var både dyrt og vanskelig og krevde at mange griser måtte bøte med livet. Ved å spleise genet for insulin inn i E. coli-bakterier og dyrke disse bakteriene i store ståltanker, bruker man bakteriene til å produsere insulinet. Insulinet blir deretter renset ut fra bakteriekulturen, og kan brukes som medisin for pasienter med diabetes type 1.
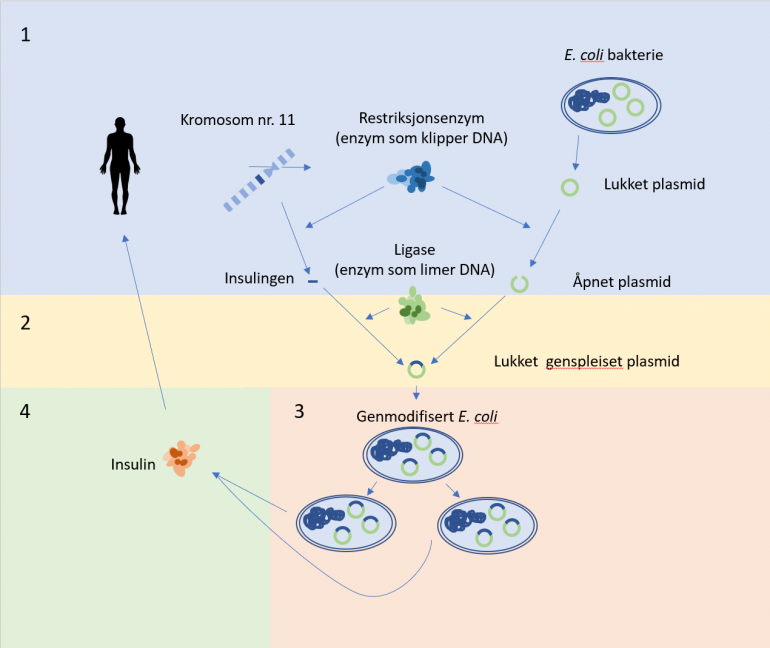
1. Insulingenet blir isolert og plasmidet blir åpnet ved hjelp av restriksjonsenzymer.
2. Insulingenet blir limt inn i plasmidet ved hjelp av ligaser og vi får da et lukket genspleiset plasmid.
3. Det genspleisede plasmidet (insulingen+plasmid) blir satt inn i en E. coli bakterie. Den genmodifiserte E.coli-en formerer seg og produserer insulin.
4. Insulin renses ut.
Figur: Håvard Øritsland Eggestøl/Bioteknologirådet
I prinsippet kan alle organismer genmodifiseres. Forskere så raskt potensialet for å bruke genteknologi til også å lage planter og dyr med nye egenskaper, og de første genmodifiserte plantene laget for forskningsformål ble utviklet allerede på 1980-tallet.
Genredigering ved Crispr-metoden
Også genredigering baserer seg på bruk av et enzym som kutter i DNA-et, men med genredigering kan gensaksen tilpasses til å klippe spesifikt og én eneste gang per genom.
Crispr-verktøyet består av proteinet Cas9, som lager dobbeltrådkutt i DNA, sammen med en kort RNA-tråd som kjenner igjen gensekvensen der Cas9-proteinet skal kutte. Det unike med Crispr-metoden er at det er svært enkelt å tilpasse gensaksen til å klippe akkurat der en ønsker i genomet ved å bytte ut guide-RNA-sekvensen.
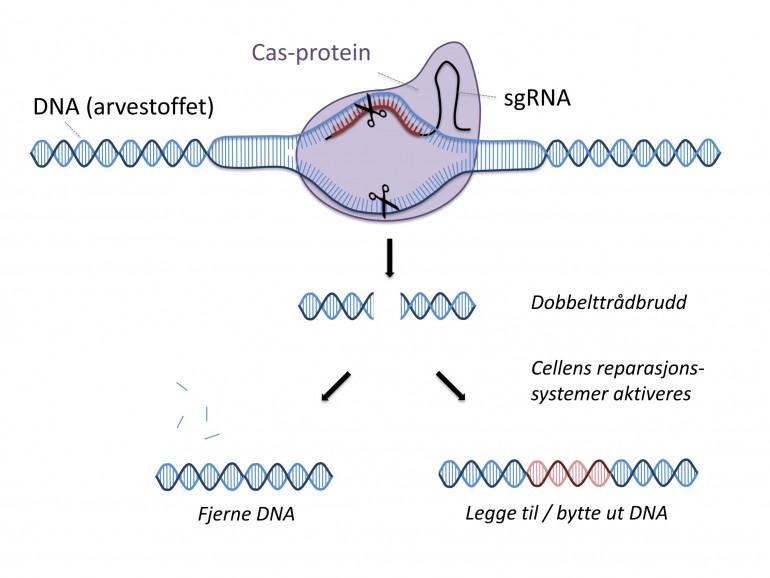
Dobbeltrådkutt i genomet kan ha alvorlige konsekvenser for celler. Derfor har cellene naturlige mekanismer for å reparere slike kutt. Disse naturlige reparasjonsmekanismene kan føre til at det settes inn eller slettes noen få basepar (vanligst), eller at det settes inn et stykke DNA, på kuttstedet. Ved genredigering utnyttes dette for eksempel til å slå ut funksjonen av et gen, gjøre mindre endringer i en genetisk sekvens eller til å få satt inn ønsket genetisk materiale ved kuttstedet.
Hvis Crispr-metoden brukes til å gjøre mindre endringer i en gensekvens eller fjerne en bit med DNA, blir ikke organismen transgen da den ikke har fått satt inn fremmed DNA. Resultatet av denne typen genredigering vil i mange tilfeller ligne naturlige mutasjoner (små genetiske endringer), som oppstår i alle organismer over tid. Hvis man bruker Crispr til å overføre genetiske materiale mellom arter vil organismen bli transgen, slik som de klassisk genmodifiserte organismene. Derfor er det uenighet om planter og dyr som har blitt endret med genredigering, bør reguleres etter det samme strenge regelverket som klassiske transgene organismer som er genmodifisert ved genspleising, eller om man skal regulere bruk av teknologien forskjellig avhengig av hva som er gjort (for eksempel om organismen har fått satt inn nytt genetisk materiale, og om den er cis- eller transgen).
Flertallet i det norske genteknologiutvalget har i NOU-en Genteknologi i en bærekraftig fremtid fra 2023 foreslått å bruke begrepet presisjonsavl i norsk lovverk. Presisjonsavl er et begrep som brukes om planter og dyr der det er gjort genetiske endringer ved bruk av moderne bioteknologi, som genredigering med Crispr, men hvor endringene kunne ha fremkommet med tradisjonelle metoder innen dyre- og planteavl. Dette står i kontrast til klassisk genmodifisering, hvor gener fra en ubeslektet art settes inn i en organismes genom for å få frem nye egenskaper som ikke forekommer naturlig i organismen. Begrepet presisjonsavl er brukt i den britiske loven The Genetic Technology (Precision Breeding) Act 2023 som fjerner presisjonsavlede organismer fra den juridiske GMO-definisjonen i England. Loven er ikke gjeldende i Skottland og Wales.
Få år etter at Crispr-metoden ble lansert er den allerede blitt tatt i bruk både innen biologisk forskning, til foredling av planter og dyr, for biodrivstoffproduksjon og Crispr-verktøyet forventes også å få stor betydning i medisinsk behandling av mennesker. Dette skyldes både at metoden er rimelig, enkel å skreddersy, og at den kan brukes til å gjøre genetiske endringer i alle celletyper og organismer.
Etiske problemstillinger
Bruken av genteknologi til å endre på genene til oss selv og livet rundt oss har satt i gang mange etiske diskusjoner. Noen av disse diskusjonene er felles for alle organismer, mens andre viser tydelige skillelinjer. Når genteknologi brukes til å endre DNA-et hos mennesker eller dyr må hvert individs interesser ivaretas og respekteres i langt større grad enn dersom en gjør genetiske endringer i arvematerialet til planter eller mikroorganismer. Ved genmodifisering av mikroorganismer eller planter er det uproblematisk å ødelegge en bakteriekultur eller kaste planter som ikke ble som ble som ønsket. Med genmodifisering av dyr vil dette være problematisk, og for mennesker helt uakseptabelt. Les mer om etiske vurderinger rundt å endre menneskers DNA på temasiden om genterapi.
Den etiske diskusjonen om genetisk endring av dyr, planter og mikrober dreier seg i stor grad om dyrevelferd og naturhensyn. Det er viktig at endringen som er gjort ikke er skadelig for miljøet. Andre sentrale prinsipper i diskusjonen er ikke-skade, nytte, rettferdig fordeling og ansvarlig forvaltning. Hvordan disse vektes er avhengig av hvilket verdisett som legges til grunn. For eksempel kan et jødisk-kristent natursyn hvor mennesket er forvaltere av Guds skaperverk stå i kontrast til dyp-økologien hvor mennesket er en del av naturen. Slike ulike natursyn kommer til sterkt uttrykk når en spør: Hva bør mennesket herske over? Bør mennesket drive avl på dyr og planter? Bør mennesket genmodifisere andre dyr og planter? Hvilken rett har vi til å genmodifisere liv? For noen kan det være prinsipielt galt å gjøre endringer i organismers DNA, selve «oppskriften» på et levende vesen. At mennesker endrer på den genetiske oppskriften kan oppfattes som «unaturlig», eller som en inngripen i Guds skaperverk.
De vanligste spørsmålene som reises rundt bruk av genteknologi brukt for å endre genomet til dyr, planter og mikrober dreier seg om trygghet. Er det trygt å spise genmodifisert mat? Er genmodifiserte avlinger dårlig for miljøet? Når det gjelder helserisiko ved å spise GMO planter har man gode metoder for å undersøke om noe er giftig eller fremkaller allergi og man har etter mange år med bruk av genmodifiserte planter god dokumentasjon på at disse er trygge å spise. Om en genmodifisert plante eller et genmodifisert dyr kan krysse seg inn i ville populasjoner eller om genetisk materiale fra GMO-er kan tas opp av jordbakterier og på den måten spre seg i økosystemet, er vanskeligere å svare på. En del vil si at det er mer akseptabelt med GMO-er som blir holdt inne på strenge laboratorier (kalt innesluttet bruk), enn GMO-er som er utendørs i fri luft (utsetting).
Spørsmål til diskusjon:
- Kan bruk av en genteknologi være etisk problematisk i seg selv eller er det hva genteknologi brukes til som er etisk relevant?
- Er det forskjell på om man endrer på gener med genspleising og genredigering?
- Er det etisk relevant om endring av gener gjøres innen en art eller på tvers av arter?
- Avl er en vanlig metode for å utvikle planter og dyr med egenskaper som vi ønsker. Kunnskap om dyr og planters genetikk gjør at vi kan krysse mer og mer spesifikt for å få de endringene landbruket ønsker. Hvordan skiller slik avl seg fra å gjøre endringer i genene til de samme dyrene og plantene hvis man bruker genteknologi?
- I hvilken grad er det greit at mennesker endrer genetikken til organismene rundt oss?
- Er det forskjell på å gjøre endringer i gener til mikroorganismer, planter og dyr?
- Bør forskere ha lov til å genetisk endre mikroorganismer på laboratoriet? Hvordan påvirker det din oppfatning hvis mikroorganismene kan brukes til å lage medisin?
- Hvis genteknologi kan bidra til å løse store samfunnsproblemer som klimakrisen eller under- og feilernæring, kan det da være uetisk å ikke ta genteknologi i bruk?
Innholdet på denne siden ble sist oppdatert i juli 2023. Send oss en e-post om du har kommentarer eller spørsmål til innholdet.




